

| Introduction |
| Technical aspects |
| Normal lymph node histology and cytology |
| Reactive lymph node |
| Hodgkin Lymphoma |
| Non Hodgkin lymphoma |
| Metastases |
TECHNICKÁ HLEDISKA
- FNC a příprava nátěrů
- Základní barvení
- Zpracování FNC materiálu a pomocné techniky
- Cytospin
- Cytoblok
- Imunocytochemie (ICC)
- Průtoková cytometrie (flow cytometry FC)
- Fluorescenční in situ hybridizace (FISH)
- Polymerázová řetězová reakce (PCR)
FNC a příprava nátěrů
- FNC hmatných uzlin je nejlepší provádět s jehlami 23-25G, s nebo bez aspirace. Malé uzliny (menší než 1cm v průměru) lze lépe zasáhnout kratší jehlou bez aspirace – dostanete se blíže k cíli.
- Fixujte uzlinu dvěma prsty, v případě axilárních uzlin se je pokuste znehybnit na hrudní stěně “tahem dolů“ dvěma prsty.
- snažte se zkrátit vzdálenost mezi kůží a uzlinou a zaveďte jehlu do hloubky nutné k projití uzlinou.
- FNC nehmatných a hlubokých uzlin se provádí pod sonografickou kontrolou. Zvolte nejkratší a nejpřímější cestu: čím delší a zešikmenější přístup je, tím větší je riziko odklonu jehly. Snažte se zasáhnout nejdůležitější oblast.
- Všímejte si vjemů při aspiraci: první odpor je tvořen kůží, poté následuje pouzdro. FNC vnitřku uzliny může vyvolávat dojem aspirace dutiny. V tom případě jste zasáhli cíl.
- Pohybujte jehlou jemně nahoru, dolů a do stran, v rozsahu odpovídajícím velikosti uzliny.
- Při pohybu jehly se dotažte pacienta, zda cítí bolest. Pokud ano, můžete být mimo uzlinu.
- Vyhodnoťte odpor aspirátu: měkký, tvrdý, fibrosní, křehký. To může pomoci při hodnocení.
- Kontrolujte vrchol jehly při aspiraci. Když se objeví materiál, okamžitě ukončete aspiraci a udělejte nátěry. Krev může snížit kvalitu vzorku a znemožnit další FNC.
- Aspirace by neměla trvat déle než 20-30 sekund s výjimkou fibrózních vzorků, delší nejsou výtěžnější a vyvolávají mikrohemoragie.
- Vypláchněte materiál velmi jemně. Pokud se rozdělí na malé kapky, můžete pořídit více nátěrů nebo cytoblok.
- Techniku volte dle kvality aspirátu: řídký zpracujte jako tekutinu, hustý jako přímý nátěr.
- Roztěr by měl být lehký s vytvořením jednovrstevného nátěru, který okamžitě zaschne bez narušení morfologie lymfocytů.
- Vyhodnoťte ihned pomocí Diff Quik barvení výtěžnost a rozhodněte, zda je třeba dalšího vpichu a také, jak dále pracovat se vzorkem.
základní barvící
Diff Quik a Papanicolaou jsou komplementární a nejužívanější barvící postupy. Diff Quik umožní okamžité vyhodnocení nátěrů, zachová pozadí a zvýrazní metachromázii pojiva a oranžová granula eozinofilů. Papanicolaouovo barvení poskytuje detailní informaci o jádře a cytoplazmě. Pokud je třeba, může být nátěr odbarven a použit pro imunocytochemické průkazy.
Zpracování FNC materiálu a speciální metody
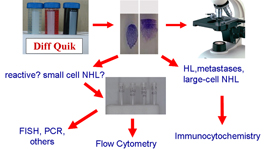
Zpracování diagnostického materiálu je základním bodem v diagnostické cytologii, a zejména vcytopatologii uzlin; perfektní nátěry a jejich okamžité hodnocení jsou prvními kroky správné a přesné diagnózy. Speciální metody jsou nezbytné pro přesnou diagnózu a nepostradatelné v diagnostice non-Hodgkinových lymfomů (NHL). Nicméně ne každá cytologická laboratoř disponuje všemi uvedenými metodami; každá má svou specifickou indikaci. Např. průtoková cytometrie, která poskytne extrémně užitečnou informaci v diagnostice a klasifikaci NHL, je neužitečná ve vyšetření Hodgkinových lymfomů (HL) a metastáz. Naproti tomu imunocytochemie v kombinaci morfologických znaků a imunofenotypu přispívá významně k diagnóze HL a metastáz; může však být méně účinná v hodnocení lehkých řetězců nebo určení T-rich B-buněčný NHL. FISH je vysoce účinná v odhalení specifických typů NHL, ale užívá se pouze výběrově po základní diagnostické orientaci. Tyto okolnosti, omezené množství materiálu a nutnost ekonomického postupu vedly k vytvoření následujícího algoritmu.
Speciální metody jsou nepostradatelné v diagnóze a klasifikaci většiny FNC uzlin. Poskytují specifické informace a měly by být použity indikovaně po zvážení klinických dat a morfologických rysů.
Cytospin
Materiál z jehly po zhotovení nátěrů nebo ze zvláštního vpichu suspendujte v pufru při pH 7.4. Jeden až dva milióny buněk získané jedním vpichem postačí k vytvoření šesti a více cytospinů pro imunocytochemii. Zaschnutím fixované cytospiny lze skladovat při pokojové teplotě až 1 týden. Skladování delší dobu (1-2 roky) vyžaduje -20°. Jak alkalická fosfatáza, tak imunoperoxidáza mohou být použity pro cytospin.
Cytoblok
Cytobloky se připravují zalitím centrifugované buněčné suspenze do parafinu. Používají se cytoblokové kazety pro buněčné suspenze. Výhodou cytobloků je možnost četných řezů, dlouhodobá skladovatelnost a imunoreaktivita shodná s tkáňovými histologickými řezy.Zpět na začátek
Imunocytochemie (ICC)
Pro tyto účely se používají etanolem fixované nátěry nebo xylenem odparafinované a alkoholem rehydrované parafinové řezy z cytobloku. Řezy se umístí do kádinky s 0.01 M tri-natriumcitrátového roztoku zahřejí 3x5 minut v mikrovlnné troubě. Po zahřátí se pečlivě oplachují 5 min. v chladné tekoucí vodě a následně v Tris-pufru (TBS) pH 7. 4. po inkubaci s primární protilátkou jsou skla převrstvena biotinylovaným anti-myším nebo anti-králičím imunoglobulinem a následně peroxidázou značeným streptavidinem (LSAB); Signál se vyvolá použitím diaminobenzidinu (DAB) jako chromogenu po inkubaci s křenovou peroxidázou po dobu 10 minut.
Průtoková cytometrie (FC)
Zbytkový materiál z jehly nebo ze zvláštního vpichu je suspendován v RMPI-1640 pufru při pH 7.4. Jeden až dva milióny buněk získaných jedním vpichem se rozdělí do 6 zkumavek pro šest základních fluoresceinem značených protilátek. Používají se v kombinaci tří nebo čtyř značených různými fluorochromy pro dvoulaserový cytometr. Je záhodno ponechat jednu zkumavku v zásobě pro další hodnocení. Konjugace se značenou protilátkou musí být časově omezená, protože vitální buňky mohou v suspenzi bobtnat. Po konjugaci lze zabránit bobtnání fixací přidáním kapky pufrovaného formalinu; analýzu lze potom odložit nebo opakovat, Výhodou průtokové cytometrie je přímá reakce antigenu a protilátky, přesná kvantifikace exprese antigenu, zjištění koexprese jednou buňkou. Nevýhodou je absence morfologie, ztráta velkých buněk, obtíže se zjištěním početně řídkých buněčných populací.
Fluorescenční in situ hybridizace (FISH)
Fluoresceinované DNA sondy se využívají k vizualizaci specifických segmentů DNA. Chromozomální abnormality, zejména translokace a delece lze znázornit a kvantifikovat. FISH lze provádět na nátěrech nebo cytospinech. Výhodou cytospinů jsou: vysoká koncentrace buněk, úspora sond a krátký čas pro analýzu.
Polymerázová řetězová reakce (PCR)
Aspirované buňky se suspendují v roztoku RNAlater® pro zachování a extrakci RNA a DNA. Buňky mohou být skladovány do extrakce DNA při pokojové teplotě. DNA segmenty jsou amplifikovány užitím oligonukleotidových sond a polymeráz v opakovaných cyklech denaturace nasednutí primerů a syntézy DNA. Produkty amplifikace jsou analyzovány gelovou nebo kapilární elektroforézou. Pro určení polyklonality a monoklonality se používá amplifikace JH lokusu těžkých řetězců nebo Tc receptoru.
Zpět na začátek