

| Wykrywanie HPV |
| Test HPV DNA w praktyce klinicznej |
| Odpowiedź Immunologiczna |
| Testy kliniczne i szczepionki |
Związek pomiędzy infekcją HPV a rakiem szyjki macicy.
Wirusy brodawczaka ludzkiego (Human Papilloma Viruses, HPV) należą do rodziny wirusów Papova. Posiadają one powinowactwo do komórek nabłonka, indukują ich proliferację, co prowadzi do rozwoju łagodnych zmian brodawkowych. Zmiany te stwierdza się układzie rozrodczym, w górnych drogach oddechowych, przewodzie pokarmowym i na skórze. W oparciu o metody molekularnej hybrydyzacji HPV DNA uzyskanego z kłykcin i zmian brodawkowych w różnych lokalizacjach zidentyfikowano około 70 typów HPV Każdy z wirusów wykazuje specyficznośc, co do miejsca infekcji, a wirusy, które charakteryzują się powinowactwem do tych samych miejsc wydają się być genetycznie podobne. Stwierdzono, że 30 z 70 typów HPV występuje w żeńskim układzie rozrodczym.
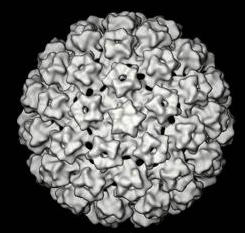 |
| Electronmicrograph of human papillomavirus |
HPV należy do wirusów DNA o średnicy około 55nm. Genom wirusa zbudowany jest z podwójnej nici DNA, w której wyróżnia się trzy regiony funkcjonalne: region kodujący geny wczesne (E), region kodujący geny pózne (L) oraz znajdujący się pomiędzy nimi długi region kontrolujący (Long Control Region, LCR).
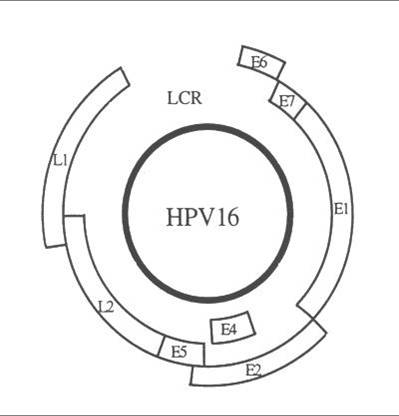 |
| HPV 16 genome structure : the coding regions are represented by open boxes (Phillips AC and Vousden KH 1998) |
| Gen/region | Funkcja |
E1/E2 |
Koduje białka, które kontrolują funkcję genów E6 i E7 |
| E4 | Funkcja nieznana, prawdopodobnie kontroluje uwalnianie wirusów z komórki |
| E5 | Koduje białko hydrofobowe, które odgrywa rolę w unieśmiertelnieniu komórki |
| E6 | Koduje białka, które hamują inhibitory cyklu komórkowego. Produkt genu E6 hamuje białko p53, które promuje apoptozę. |
| E7 | Koduje białka, które wiążą się białkiem pRB, co warunkuje progresję komórki w cyklu komórkowym przy braku sygnałów mitogennych |
| L1/L2 | Koduje białka strukturalne i odpowiada za tworzenie kompletnych cząstek wirusa. |
| LCR | Niezbędny do prawidłowej replikacji wirusa i kontroli ekspresji genów. |
Historia naturalna zakażenia nabłonka szyjki macicy wirusem HPV i zmiany morfologiczne związane z tym zakażeniem.
Wiek w momencie zakażenia HPV: zakażenie HPV jest jedną z najczęściej występujących chorób przenoszonych drogą płciową. 75% kobiet przed 50 rokiem życia jest co najmniej raz zakażonych HPV. Odsetek zakażeń jest najwyższy u nastolatek i u kobiet w trzeciej dekadzie życia. Po tym okresie, odsetek zakażeń zmniejsza się prawdopodobnie w następstwie odporności przeciwwirusowej. Wirus HPV może przetrwac jako zakażenie latentne (utajone), które można wykryc tylko metodami diagnostyki molekularnej.
Drogi zakażenia:: HPV infekuje komórki warstwy podstawnej nabłonka (zwykle w strefie transformacji). Replikacja wirusa występuje w czasie podziałów komórek podstawnych. HPV może pozostawac w komórkach warstwy podstawnej w formie latentnej (nieaktywnej) lub ulegac dalszej replikacji w czasie, gdy komórki warstwy podstawnej ulegają dojrzewaniu i przemieszczają się w stronę powierzchni nabłonka. Wykładnikiem zakażenia HPV w preparatach histologicznych i cytologicznych jest tzw. efekt cytopatyczny, który charakteryzuje się koilocytozą, parakeratozą i rogowaceniem pojedynczych komórek. Ostre zakażenie HPV może ulec spontanicznej regresji lub przetrwac, jako zakażenie utajone, z możliwością ponownej reaktywacji.
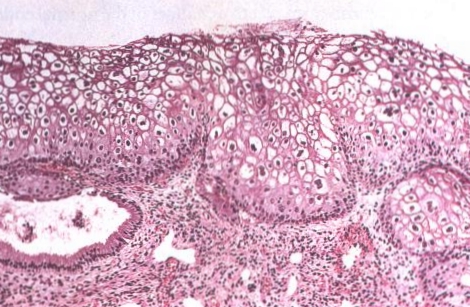 |
| LSIL (CIN 1) of the cervix. This lesion, also known as flat confyloma, is characterized by koilocytotic atypia and usually is associated with HPV 6 or HPV 11 infection. |
Dowody potwierdzające koncepcję roli HPV w rozwoju raka szyjki macicy.
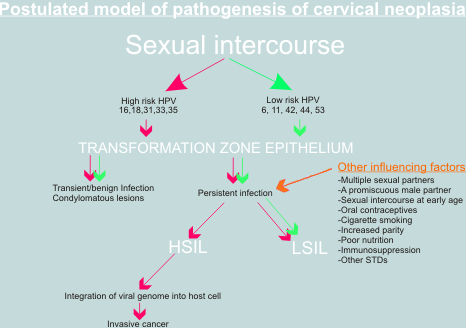
W 1977 roku opublikowano dwie prace, które po raz pierwszy wykazały obecność HPV w nabłonku szyjki macicy (Meisels & Fortin 1977; Purola & Savia 1977). Autorzy tych prac stwierdzili obecność koilocytów w rozmazach z szyjki macicy i w wycinkach z CIN. Opisali oni zmiany w nabłonku szyjki macicy, pochodzącym ze zmian brodawkowych, które określili, jako "brodawki płaskie" lub "brodawki nie-kłykcinowe". Dalsze badania potwierdziły obecność antygenów wirusa i wirusowego DNA w komórkach nabłonka szyjki macicy i wykazały, że obecność DNA wirusa HPV jest często związana ze zmianami o typie CIN1. Ich obserwacje zainicjowały dalsze szeroko zakrojone badania nad rolą HPV w karcynogenezie raka szyjki macicy (Coleman and Richman 1983).
Analiza DNA pochodzącego ze zmian brodawkowych zlokalizowanych w okolicy narządów płciowych, okolicy odbytu, z nabłonka z cechami CIN i z raka szyjki macicy wykazały obecność dwóch grup wirusów HPV. Pierwsza grupa to wirusy niskiego ryzyka rozwoju raka szyjki macicy. Są one prawie zawsze związane z występowaniem CIN1 i kłykcin zlokalizowanych w okolicy narządów płciowych i okolicy odbytu. Druga grupa to wirusy wysokiego ryzyka rozwoju raka szyjki macicy. Stwierdza się je najczęściej w nabłonku z cechami CIN2 i CIN3.
Ryzyko rozwoju raka szyjki macicy w zależności od typu wirusa HPV przedstawiono poniżej.
Typy wirusa HPV, które występują w żeńskim układzie rozrodczym.
| High risk | |
| 16,18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68 may lead to Invasive Cancer | |
| Low risk | |
| 6, 11, 42, 44, 53, 54, 62, 66 may lead to condylomata | |
Potencjał onkogenny wirusów HPV.
Wirusy HPV wysokiego ryzyka charakteryzują się wybitnym potencjałem onkogennym. W badanich in vitro stwierdzono, że ludzkie keratynocyty, które przypominają komórki docelowe dla HPV, transfekowane wirusami z grupy wysokiego ryzyka (HPV16 i HPV 18) charakteryzują się dłuższym okresem życia. Keratynocyty transfekowane wirusami niskiego ryzyka (HPV6 i HPV11) dojrzewają i umierają w tym samym czasie co komórki nie transfekowane. Ponadto ludzkie keratynocyty transfekowane HPV16 i HPV18 wykazują cechy morfologiczne podobne do obserwowanych w nabłonku z cechami CIN.
Najbardziej przekonywującym dowodem potwierdzającym rolę HPV w karcynogenezie raka szyjki macicy jest sposób integracji DNA HPV z DNA gospodarza w komórkach nabłonka szyjki macicy. DNA HPV w warunkach prawidłowych, w kłykciach i w nabłonku z cechami CIN1 występuje w postaci episomalnej (tj. bez związku z genomem gospodarza). DNA HPV w komórkach raka szyjki macicy jest zintegrowany z DNA gospodarza. Integracja z HPV DNA z DNA gospodarza powoduje zaburzenie ekspresji genów E1 i E2, które w warunkach prawidłowych kontrolują geny E6 i E7 oraz zaburzenie otwartych ramek odczytu genów E6 i E7. Białkowe produkty genów E6 i E7 hamują funkcję genów supresorowych (TP53 i RB), co prowadzi do ominięcia punktów kontroli cyklu komórkowego (G1 i G2) i niekontrolowanej proliferacji.
Integrację HPV DNA z DNA gospodarza stwierdza sie we wszystkich rakach zawierających HPV16 i HPV18. Stanowi to najważniejszy dowód na znaczenie HPV16 i HPV18 w patogenezie raka szyjki macicy.
 |
Znaczenie innych czynników.
Wiadomym jest, że zakażenie HPV wysokiego ryzyka lub nawet integracja HPV16 z DNA gospodarza nie jest wystarczająca do pełnej transformacji złośliwej komórek nabłonka szyjki macicy. Zakażenie układu rozrodczego HPV16 jest stosunkowo częste, a rak szyjki macicy rzadki. Ponadto integrację HPV DNA stwierdza się także w niektórych przypadkach kłykcin i w nabłonku z cechami CIN. W patogenezie raka szyjki macicy mogą odgrywac rolę także inne czynniki, takie jak: upośledzona odpowiedz immunologiczna, przetrwałe zakażenie wirusowe, palenie papierosów, przyjmowanie doustnych środków antykoncepcyjnych. Wyłączenie genów supresorowych (delecja, mutacja) lub aktywacja onkogenów może także odgrywac rolę w patogenezie raka szyjki macicy. W badaniach na liniach komórek raka szyjki macicy in vitro stwierdzono mutacje RAS, FOS i innych onkogenów, ale znaczenie tych mutacji in vivo nie jest jeszcze w pełni poznane. Badania nad rolą HPV w patogenezie raka szyjki macicy stanowią teoretyczną przesłankę do wprowadzenia metod zapobiegania rakowi szyjki macicy (szczepienia), nowych metod wczesnego wykrywania (skryning HPV DNA) i nowych sposobów leczenia (leki przeciwwirusowe).
Związek między HPV a rakiem szyjki macicy.. Ryzyko względne jest bardzo wysokie i porównywalne z ryzykiem wystąpienia pierwotnego raka wątroby w przebiegu przewlekłego wirusowego zapalenia wątroby typu B. Jest ono także wyższe niż w przypadku palenia papierosów i ryzyka rozwoju raka płuca.