| Detección del VPH |
| Pruebas de ADN para VPH en la práctica clínica |
| Respuesta inmune |
| Pruebas clínicas y vacunas |
Pruebas clínicas de las vacunas profilácticas contra VPH
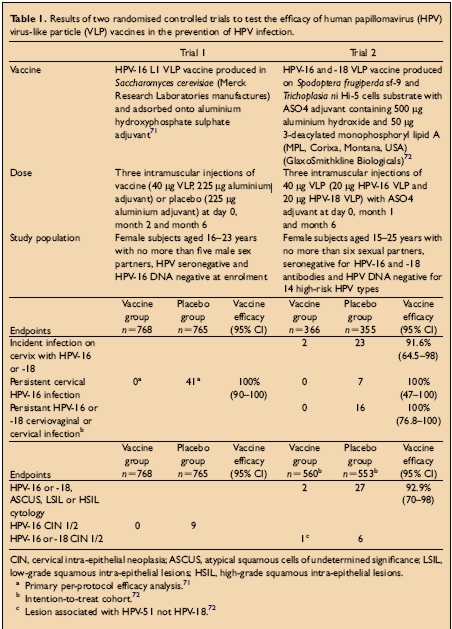
Ha habido dos amplios estudios clínicos controlados aleatorios doble ciego de vacunas del virus de papiloma. Ambos han mostrado protección contra la infección resistente HPV y la enfermedad cervical con tipos homólogos VPH y luego de la inmunización con VLPs HPV. La población, dosis, vacunas utilizadas, puntos de corte de este estudio son mostrados en la tabla a continuación:
Williamson et al
Stratergies for the prevention of cervical cancer by human papillomavirus vaccination
Best Practice & Research Clinical Obstetrics & Gynaecology (2005) 19-4 pp531-544
Prueba 1: Infección persistente por VPH definida como la detección del ADN del VPH 16 en muestras obtenidas en dos o más visitas
Prueba 2: Infección persistente con el VPH 16/18 definida como al menos dos pruebas PCR positivas para el mismo genotipo separadas por al menos 6 meses.Para mayor información acerca de como se llevaron a cabo estas pruebas consulte:
LA Koutsky,KA Ault and CM Wheeler et al
A controlled trial of a human papillomavirus type 16 vaccine
New England Medical J (2002) 347 (pp1757-1765DM Harper,EL Franco and C Wheeler et al
Efficacy of a bivalent L1 virus-like particle vaccine in prevention of infection with HPVtypes 16 and 18 in young women: a randomised controlled trial.
Lancet (2004) 364pp1757-1765Una nueva vacuna contra los virus del papiloma humano
Gardasil es una nueva vacuna que está siendo comercializada por Sanofi Pasteur/ Merck and Co en Europa como la primera vacuna contra el cáncer de cuello uterino en el mundo. La vacuna está diseñada para prevenir la infección contra los virus del papiloma humano genital (VPH tipos 6,11,16,18) que son la causa más común de verrugas genitales y cáncer de cuello uterino. En estudios clínicos a gran escala de la vacuna, mujeres de 16 a 23 años que no tenían infección por VPH antes del estudio estaban aún libres de infección por VPH 6,11,16 y 18 cinco años más tarde y ninguna había desarrollado cambios precancerosos o cancerosos en el cuello uterino.La vacuna fue aprobada para uso clínico por la Agencia Americana de Alimentos y Medicamentos en junio del 2006. Unos meses más tarde la agencia médica europea (EMEA) concedió la licencia para el uso de la vacuna en los 25 países de la Unión Europea. Otros países que han aprobado el uso de Gardasil incluyen Canadá, Méjico, Brasil, Australia, y Nueva Zelanda.
Debido a que la infección genital con los virus del papiloma humano es una enfermedad de transmisión sexual común, es aconsejable que las niñas sean vacunadas antes del comienzo de la actividad sexual. Así, para máxima eficiencia, las inyecciones de la vacuna deben ser dadas a niñas jóvenes y adolescentes antes de la exposición al VPH. Este protocolo fue respaldado por la Administración Americana de Alimentos y Medicamentos (FDA) y EMEA y otras agencias nacionales. De hecho, el Comité de Consejo Americano en Prácticas de Inmunización (ACIP) llegó a recomendar que Gardasil se incluyera en el esquema de inmunización infantil para niñas entre los 11 y 12 años.
La reacción a la nueva vacuna por parte de los proveedores de salud, políticos, grupos de mujeres, y otros grupos de interés, ha sido muy variada. En noviembre del 2006 el Gobierno Australiano anunció la vacunación gratuita para todas las mujeres de 12 a 26 años en el 2007. Una medida similar ha sido aprobada por el Gobierno Alemán. En los Estados Unidos de América, 20 estados han redactado legislación en apoyo a la vacunación obligatoria de niñas de 10 a 12 años. Esto ha encontrado fuerte oposición por parte de los trabajadores de la salud, políticos, y grupos de mujeres, quienes consideran que esto infringe los derechos de los padres. Otros objetan que la vacunación a adolescente contra enfermedades de transmisión sexual, bajo la premisa que esto promoverá la promiscuidad.Los temas éticos que rodean la administración de una nueva vacuna son sólo uno de los problemas asociados con Gardasil. Los ginecólogos y los trabajadores de la salud están preocupados que la vacuna no ha sido suficientemente probada para medir efectos secundarios a largo plazo, y la duración de la protección contra la infección del HPV 6,11, 16, 18 no es aún conocida. Se necesitan estudios a largo plazo para definir si la vacunación por si misma puede proteger contra el cáncer de cuello uterino. Merck and Co, quienes desarrollaron la vacuna, reconocen que esta sólo puede proveer protección contra el 70% de todos los cánceres cervicales, y que una vacuna que pueda proteger contra todos los tipos de VPH asociado con el cáncer de cuello uterino presenta un reto mayor.
A pesar que Merck and Co resaltan que las mujeres que reciban la vacuna deben continuar con las pruebas Pap regulares, hay una preocupación que después de la vacuna las mujeres puedan adquirir un falso sentido de seguridad y no asistan a los controles. En todas las discusiones llevadas a cabo alrededor de la introducción de la vacuna, hay una clara y concisa afirmación que se necesita un seguimiento continuo de todas las mujeres vacunadas. Adicionalmente, se debe llegar un registro de todos aquellos vacunados.