

| Detección del VPH |
| Pruebas de ADN para VPH en la práctica clínica |
| Respuesta inmune |
| Pruebas clínicas y vacunas |
La asociación de los virus del papiloma humano y el cáncer de cuello uterino
Los virus del papiloma humano (VPH) son miembros de la familia conocida como Papovavirus. Son virus epiteliotróficos que promueven la proliferación celular que resulta en el desarrollo de lesiones papilomatosas benignas del tracto genital, respiratorio, digestivo, y lesiones cutáneas de la piel. Se han identificado más de 70 tipos distintos de VPH como resultado de hibridización molecular del ADN extraído de condilomas o lesiones verrucosas de varios lugares. Cada tipo de virus tiene un sitio muy restringido de infección y los virus que ocupan nichos similares parecen estar relacionados genéticamente. La hibridización molecular de verrugas anogenitales y biopsias cervicales han mostrado que cerca de 30 de los 70 tipos distintos de VPH están confinados al tracto genital femenino.
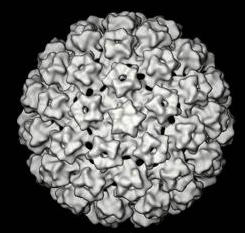 |
| Electromicrofotografía del virus del papiloma humano |
Los papiloma virus son virus pequeños sin envoltura de ADN que tienen aproximadamente 55nm de diámetro. Su genoma está compuesto de una doble hélice de ADN y tienen tres regiones de codificación funcional: una región para codificar regiones virales tempranas (E), una región para codificar funciones virales tardías (L), y una región de control largo (LCR) que se encuentra entre las dos primeras.
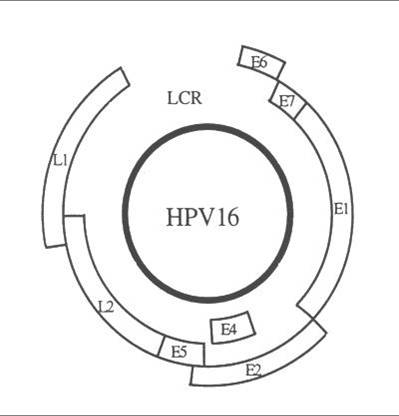 |
| HPV 16 genome structure : the coding regions are represented by open boxes (Phillips AC and Vousden KH 1998) |
| Gene/Region | Function |
E1/E2 |
Código para proteínas que controlan la función de los genes E6 y E7 |
| E4 | Una función principalmente desconocida pero que puede controlar la liberación del virus de las células |
| E5 | Códigos para una proteína hidrofóbica que realza la inmortalización de la célula |
| E6 | Código de proteínas que inhiben los reguladores negativos del ciclo celular. Los productos de E6 inhiben la p53 que es un factor de trascripción para la apoptosis (muerte celular programada) |
| E7 | Códigos de los productos que se unen a las proteínas supresoras de tumor del retinoblastoma permitiendo así que las célula progrese a través del ciclo celular en la ausencia de signos mitogénicos normales |
| L1/L2 | Código para las proteínas estructurales y formación de partículas completas de virus |
| LCR | Necesaria para la replicación normal del virus y el control de la expresión genética |
Historia natural de la infección por VPH del epitelio cervical y cambios morfológicos asociados a la infección.
Historia natural de la infección por VPH del epitelio cervical y cambios morfológicos asociados a la infección. Edad de adquisición de la infección por VPH: VPH es una de las enfermedades de transmisión sexual más comunes. 75% de las mujeres ha adquirido al menos una infección por VPH para la edad de 50 años. Las tasas de infección son más altas en las adolescentes y mujeres en la segunda década de la vida. Después de esta edad, las tasas parecen declinar posiblemente a través del desarrollo de inmunidad al virus. Sin embargo el virus puede persistir como un pequeño foco de infección latente que es solamente detectable a nivel molecular.
Ruta de la infección: El VPH entra a través de la capa basal del epitelio (usualmente la zona de transición) donde el virus se replica a medida que las células basales se dividen. El virus puede persistir en la capa basal en forma latente (inactiva) o puede continuar su replicación a medida que las capas basales se diferencian y ascender a través del epitelio donde el efecto citopático puede ser reconocido en cortes histológicos y frotis citológicos como: coilocitos, paraqueratosis y queratinización de células individuales. La infección aguda puede resolverse con una regresión espontánea de las lesiones o puede persistir como infección latente que puede reactivarse en cualquier momento.
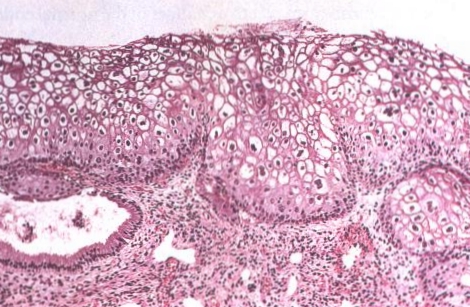 |
| LSIL (CIN1) del cervix. Esta lesión también conocida como condiloma plano, se caracteriza por la atipia coilocítica y está usualmente asociado con la infección por el VPH6 o VPH11 |
La evidencia que sustenta el concepto que VPH tiene un papel en la carcinogénesis cervical.
En 1977 dos informes que sugerían por primera vez que el virus del papiloma humano podía estar presente en el epitelio cervical fueron publicados (Meisels & Fortin 1977; Purola & Savia 1977). Estos autores notaron la presencia de coilocitos en los frotis de cuello uterino y biopsias de mujeres con NIC. Ellos describieron las lesiones en el epitelio cervical que demostraban cambios verrucosos y que ellos designaron "verrugas planas" o "verrugas no condilomatosas". Investigaciones posteriores confirmaron la presencia de antígenos virales y ADN de VPH en los núcleos de la células epiteliales del cuello uterino y establecieron que la presencia del ADN del VPH era frecuentemente asociada con un foco de NIC1. Sus observaciones proporcionaron el estímulo para extensas investigaciones en el papel del VPH en el origen del cáncer de cuello uterino (Coleman and Richman 1983).
Los análisis de ADN de las verrugas anogenitales, NIC y tejido cervical con cáncer han mostrado que dos grupos de VPH pueden ser identificados en el tracto genital femenino. Un grupo de VPH es casi siempre asociado con las lesiones NIC de bajo grado y las verrugas anogenitales exofíticas que tienen un bajo riesgo de progresar a cáncer de cuello uterino. Un segundo grupo de viruses es encontrado más comúnmente en NIC2 y NIC3 y tienen un alto riesgo de desarrollar cáncer invasivo.
El potencial oncogénico de los virus de los diferentes grupos ha sido ampliamente estudiado y se discute a continuación.
HPV types found in El tracto genital femenino
| High risk | |
| 16,18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68 may lead to Invasive Cancer | |
| Low risk | |
| 6, 11, 42, 44, 53, 54, 62, 66 may lead to condylomata | |
El potencial oncogénico del VPH
La habilidad de los genes virales de alterar las propiedades de las células epiteliales ha sido investigado exhaustivamente y muestra que los virus en el grupo de alto riesgo tienen notables propiedades oncogénicas. Los ensayos in vitro de queratinocitos humanos (que semejan las células normales objetivo del virus) que han sido infectadas con VPH de alto y bajo riesgo muestran que los virus del grupo de alto riesgo (VPH16 y VPH18) tienen la habilidad de inmortalizar los queratinocitos humanos primarios esto es, extender su tiempo de vida. En comparación los virus de los grupos de bajo riesgo (VPH-6 y VPH-11) no extienden el tiempo de vida de las células humanas infectadas, las cuales maduran y mueren al mismo tiempo que las células no infectadas. Así mismo, los virus de bajo riesgo se desempeñan pobremente en experimentos concernientes con la transformación maligna de células de roedores en comparación con los tipos de VPH de alto riesgo. Mas aun, queratinocitos humanos infectados con VPH-16 y VPH-18 en cultivos raft (un medio de cultivo organotípico) muestran un patrón de diferenciación muy similar al visto en NIC en vivo.
La evidencia más convincente que los virus del papiloma humano juegan un papel importante en el proceso oncogénico está basada en los patrones de integración del ADN del VPH en las células del cuello uterino. Mientras que el ADN del VPH se mantiene normalmente episomal (esto es, separado del núcleo) en condilomas y NIC de bajo grado, en lesiones cancerosas el ADN viral se integra en el genoma de las células huésped. La integración causa la disrupción de la expresión de los genes E1 y E2 que normalmente controlan los genes E6 y E7 y la desregulación de los marcos de lectura abierta de E6 y E7. Los productos de las proteínas de las regiones codificadoras de E6 y E7 bloquean la función normal de los genes supresores de tumor (p53 y el gen supresor de tumor Rb) de este modo permitiendo a las células evitar los puntos normales de chequeo del ciclo celular en G1 y G2, resultando en una proliferación celular descontrolada.
La integración es un hallazgo consistente en todos los cánceres que tienen virus de alto riesgo VPH16 y VPH18 y provee la evidencia más firme que el VPH16 y el VPH18 juegan un papel importante en el desarrollo del cáncer de cuello uterino. El ADN del VPH está presente en el 90% de todos los casos de cáncer invasivo de cuello uterino.
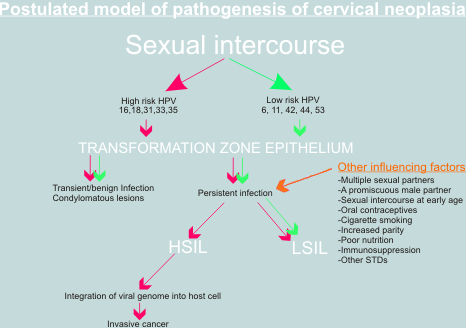 |
La importancia de los co-factores
Es ampliamente reconocido que la simple infección con VPH de alto riesgo o aún la integración del VPH 16 en el núcleo de la célula huésped no son suficientes para la completa transformación maligna del epitelio cervical. La infección del tracto genital con el VPH 16 es relativamente frecuente mientras que el cáncer invasivo es raro; y la integración ha sido detectada en algunos casos de verrugas genitales y lesiones NIC. Un número de posibles co-factores han sido propuestos tales como una defectuosa respuesta inmune, persistencia de los virus, fumar y la administración de hormonas esteroides (tales como anticonceptivos). Otros eventos genéticos como la pérdida de genes de supresión tumoral y la activación de oncogenes pueden también jugar un papel. Las mutaciones en ras, fos y otros oncogenes han sido detectadas en algunos linajes de células cervicales cancerígenas pero su papel en vivo está aun por ser determinado. A pesar de los vacíos en nuestro conocimiento, los virus del papiloma han proporcionado un entendimiento excepcional de los mecanismos de carcinogénesis y han permitido el avance de nuestro conocimiento de la etiología del cáncer de cuello uterino que tiene implicaciones para el futuro en términos de prevención (a través de la vacunación), diagnóstico temprano (a través de la investigación del ADN del VPH) y el tratamiento (a través de drogas antivirales) de ésta critica enfermedad.
La asociación del VPH y el cáncer de cuello uterino: El riesgo relativo es muy alto y es comparable con aquel de la hepatitis B crónica y el cáncer de hígado y mayor que el riesgo relativo de fumar y el cáncer de pulmón.