| Detecting HPV |
| HPV DNA testing in clinical practice |
| Immune response |
| Clinical trials and vaccines |
Klinické studie profylaktických vakcín HPV
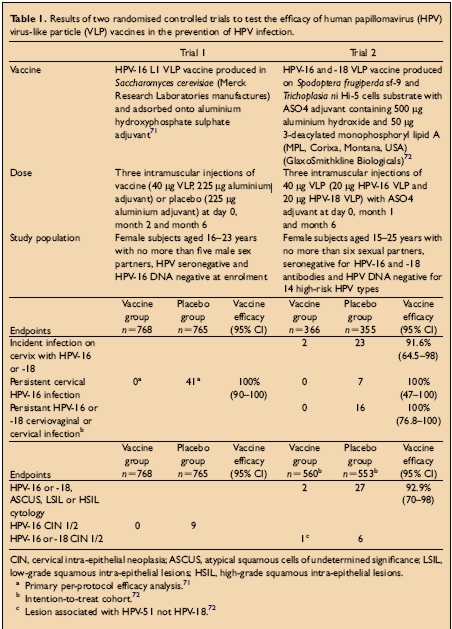
Byly provedeny dvě velké dvojitě zaslepené randomizované kontrolované klinické studie papilomavirových vakcín. Obě prokázaly ochranu proti perzistující HPV infekci homologními viry po imunizaci příslušnými viru podobnými partikulemi. Populaci ve studii, dávky, použité vakcíny a výsledky udává následující tabulka.
Williamson et al
Stratergies for the prevention of cervical cancer by human papillomavirus vaccination
Best Practice & Research Clinical Obstetrics & Gynaecology (2005) 19-4 pp531-544
Trial 1: Persistentní HPV infekce definovaná jako detekce HPV16 DNA ve vzorcích ze dvou nebo více po sobě následujících vyšetření
Trial 2: Persistentní infekce viry HPV 16/18 definovaná jako minimálně dva pozitivní testy PCR téhož genotypu v odstupu minimálně 6 měsíců.Další informace o provedení studií naleznete v:
LA Koutsky,KA Ault and CM Wheeler et al
A controlled trial of a human papillomavirus type 16 vaccine
New England Medical J (2002) 347 (pp1757-1765DM Harper,EL Franco and C Wheeler et al
Efficacy of a bivalent L1 virus-like particle vaccine in prevention of infection with HPVtypes 16 and 18 in young women: a randomised controlled trial.
Lancet (2004) 364pp1757-1765Nová vakcína proti lidským papilomavirům
Gardasil* je nová vakcína distribuovaná firmou Sanofi Pasteur/ Merck and Co v Evropě jako první vakcína proti cervikálnímu karcinomu na světě. Je konstruována k prevenci infekce genitálními papilomaviry (HPV typy 6, 11, 16&18) , které jsou nejčastějšími vyvolavateli genitálních bradavic a cervikálního karcinomu. V rozsáhlých klinických testech žen 16-23 let , které nebyly infikovány před vakcinací, neměly infekci HPV 6, 11, 16 a 18 ani po pěti letech a u žádné se nerozvinula prekanceróza nebo karcinom.Vakcína byla schválena pro klinické užití American Food and Drug Agency v červnu 2006. O několik měsíců později ji schválila European Medical Agency (EMEA) pro použití v 25 zemích Evropské unie. Dalšími zeměmi, které schválily použití Gardasilu jsou Kanada, Mexiko, Brazílie, Austrálie a Nový Zéland.
Protože pohlavní infekce lidskými papilomaviry je běžná sexuálně přenosná infekce, je žádoucí vakcinovat dívky před zahájením sexuálního života. Pro maximum účinku by měly být injekce aplikovány před expozicí HPV. Tento potokol byl schválen US Food and Drug Administration (FDA) a EMEA I dalšími národními agenturami. Dokonce American Advisory Committee on Immunisation Practices (ACIP) doporučil zařadit Gardasil do dětských imunizačních programů u dívek 11-12 letých.
Reakce poskytovatelů zdravotní péče, politiků ženských hnutí a dalších zájmových skupin na novou vakcínu byla velmi různá. V listopadu 2006 australská vláda oznámila bezplatnou vakcinaci všech
12-26 letých žen v roce 2007. Podobně v Německu ( a v ČR) V USA, 20 států navrhlo povinnou vakcinaci školních dívek 10 – 12letých. Setkalo se to však s odporem zdravotníků, politiků a ženských organizací, které to považovaly za narušení rodičovských práv. Jiní namítali, že jde o opatření, které očkováním proti sexuálně přenosné chorobě podpoří promiskuitu.Etické otázky kolem vakcinace jsou pouze částí problému. Gynekologové a zdravotníci upozorňují na to, že vakcína není dostatečně testovaná na dlouhodobé vedlejší účinky a není ani známa délka ochrany proti infekci HPV6, 11, 16, 18 .
K stanovení, zda pouhá vakcinace ochrání před cervikálním karcinomem, je třeba dlouhodobých studií. Merck and Co – výrobci vakcíny deklarují ochranu ze 70%. Vakcína s účinkem proti všem HPV typům je zatím problémem k řešení.Ačkoli Merck and Co prohlašují, že vakcinované ženy by měly pokračovat ve screeningu, vzniká obava, že by mohly získat falešný pocit bezpečí a přestat docházet pravidelně na Pap test. Závažnými položkami ze všech diskuzí, které provázely start vakcinace je jasný apel, že vakcinované ženy mají být dále sledovány a všechny osoby, které dostaly vakcínu by měly být v registru.
IARC Handbooks of Cancer Prevention ()ume 10 Cervix Cancer Screening
Chapter 1:pp26-45 Aetiology of cervical cancer
Szarewski A. Prophylactic HPV vaccines. [Review] [47 refs] [Journal Article. Review] European Journal of Gynaecological Oncology. 28(3):165-9, 2007.
UI: 17624079JAMA. 2007 Aug 15;298(7):743-53. Links to comments in
JAMA. 2007 Aug 15;298(7):805-6. Effect of human papillomavirus 16/18 L1 viruslike particle vaccine among young women with preexisting infection: a randomized trial. Hildesheim A, Herrero R, Wacholder S and others