Trials clinici dei vaccini per la prevenzione di HPV
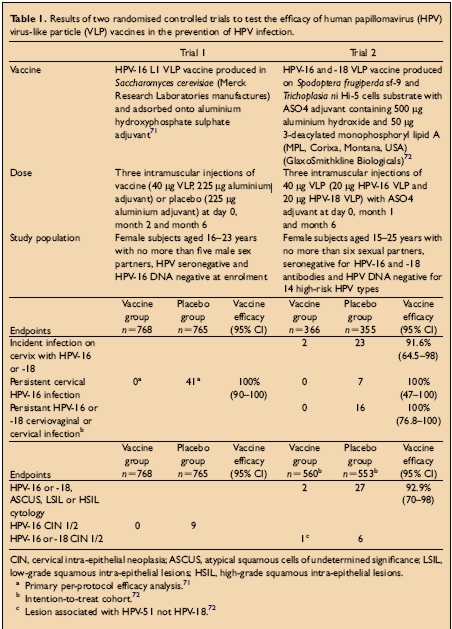
Ci sono stati due ampi trials clinici dei vaccini per il papillomavirus, controllati e randomizzati, "a doppio cieco". Entrambi hanno mostrato una protezione dalla infezione persistente da HPV e dalla malattia cervicale con tipi di HPV omologo dopo l'immunizzazione con i VLP di HPV. La popolazione di studio, le dosi, i vaccini impiegati e gli scopi finali del trial sono mostrati nella tabella sottostante:
Williamson et al
Stratergies for the prevention of cervical cancer by human papillomavirus vaccination
Best Practice & Research Clinical Obstetrics & Gynaecology (2005) 19-4 pp531-544
Trial 1: Infezione HPV persistente definita mediante rilevamento di HPV16 DNA in campioni ottenuti in due o più visite
Trial 2: Infezione persistente con HPV16/18 definita come almeno due analisi positive per lo stesso genotipo separate da almeno 6 mesi.For further information about the conduct of the trials consult:
LA Koutsky,KA Ault and CM Wheeler et al
A controlled trial of a human papillomavirus type 16 vaccine
New England Medical J (2002) 347 (pp1757-1765DM Harper,EL Franco and C Wheeler et al
Efficacy of a bivalent L1 virus-like particle vaccine in prevention of infection with HPVtypes 16 and 18 in young women: a randomised controlled trial.
Lancet (2004) 364pp1757-1765UN NUOVO VACCINO CONTRO I PAPILLOMAVIRUS UMANI
Gardasil* è un nuovo vaccino messo in commercio da Sanofi Pasteur/ Merck and Co in Europa come il primo vaccine anticancro cervicale. Il vaccino è studiato per prevenire l'infezione dai papillomavirus umani genitali (HPC tipi 6, 11, 16 e 18), che costituiscono le cause più comuni di verruche genitali e cancro cervicale. Nei trials clinici del vaccino su larga scala, le donne di 16-23 anni che non avevano contratto l'infezione da HPV prima del trial erano ancora prive di infezione da HPV 6, 11 16 e 18 dopo cinque anni e nessuna aveva sviluppato modificazioni cancerose o precancerose nella cervice.Il vaccino è stato approvato per l' uso clinico dalla American Food and Drug Agency nel Giugno 2006. Alcuni mesi dopo, la European Medical Agency (EMEA) ha rilasciato la licenza per l'uso del vaccino nei 25 paesi della Unione Europea. Fra gli altri paesi che hanno approvato l'uso del Gardasil vi sono Canada, Messico, Brasile, Australia e Nuova Zelanda.
Dato che l'infezione genitale dei papillomavirus umani è una comune malattia sessualmente trasmessa, è consigliabile che il vaccino sia dato alle ragazzine prima che divengano sessualmente attive. Pertanto, per la massima efficienza, le iniezioni del vaccino dovrebbero essere date alle ragazzine ed alle adolescenti prima dell'esposizione ad HPV. Questo protocollo è stato approvato dalla US Food and Drug Administration (FDA), dalla EMEA e da altre organizzazioni nazionali. Infatti la American Advisory Committee on Immunisation Practices (ACIP) si è spinta fino a raccomandare che il Gardasil sia posto nello schema di vaccinazioni dell'infanzia per le bambine alla visita degli 11-12 anni di età.
La reazione dei sanitari, dei politici, dei gruppi femminili e di altri gruppi interessati al nuovo vaccino è stata molto variabile. Nel Novembre 2006 il governo australiano ha annunciato una vaccinazione gratuita a tutte le persone di sesso femminile di 12-26 anni di età nel 2007. Un provvedimento simile è stato approvato dal governo tedesco. Negli Stati Uniti 20 stati hanno firmato la legislazione a sostegno di una vaccinazione di massa delle bambine di 10-12 anni. Questo si è scontrato con una forte opposizione da parte dei lavoratori in ambito sanitario, dei politici e dei gruppi femminili che lo considerano come una violazione dei diritti dei genitori. Altri si oppongono alla vaccinazione delle adolescenti ad una malattia sessualmente trasmessa per il fatto che potrebbe promuovere la promiscuità.La questione etica che riguarda la somministrazione di un nuovo vaccino non è che uno dei problemi associati al Gardasil. I ginecologi ed i lavoratori sanitari sono preoccupati che il vaccino sia stato insufficientemente sperimentato per gli effetti collaterali a lungo termine e che la durata di protezione nei confronti di HPV 6, 11, 16, 18 non sia ancora conosciuta. Sono necessari studi a lungo termine per determinare se la vaccinazione da sola sia in grado di proteggere dal cancro cervicale. Merck and Co che hanno sviluppato il vaccino riconoscono che il vaccino può fornire protezione solamente al 70% di tutti i cancri cervicali e che un vaccino in grado di proteggere verso tutti i tipi di HPV associati con il cancro cervicale rappresenta una sfida maggiore.
Sebbene Merck and Co abbiano specificato che le donne che ricevono il vaccino dovrebbero continuare ad avere regolari Pap tests, c'è preoccupazione che dopo la vaccinazione le donne possano acquisire un falso senso di sicurezza, non presentandosi ai regolari controlli. Accanto alle gravi omissioni di tutte le discussioni scatenatesi intorno all'introduzione del vaccino, si deve affermare chiaramente e brevemente che vi è necessità di un continuo controllo e follow-up di tutti i soggetti che sono stati vaccinati. Inoltre dovrebbe essere conservato un registro di tutti riceventi del vaccino.