| Pap Test |
| Pobieranie wymazów |
| Organizacja laboratorium, przygotowanie rozmazów i skryning |
| Terminologia i formułowanie wyników |
Wskazania dotyczące organizacji laboratorium, wykonywania rozmazów i skriningu.
Etapy pracy w laboratorium cytologicznym:
- Laboratorium otrzymuje preparat i załącznik do badania.
- Wprowadzenie referencyjnego numeru laboratorium.
- Wprowadzenie danych identyfikacyjnych pacjentki i numeru rozmazu do bazy komputerowej.
- Barwienie, nakrywanie i oznaczenie rozmazu.
- Pierwotny skrining.
- Ocena wszystkich rozmazów przez drugiego skrinera, konsultacja rozmazów nieprawidłowych z patologiem.
- Napisanie wyniku badania i wysłanie go do tego, kto rozmaz pobrał.
- Poinformowanie pacjentki o wyniku.
- Upewnienie się, że odpowiednie działania zostały podjęte w przypadku nieprawidłowego wyniku.
Przyjęcie rozmazów do laboratorium
- Sprawdzic czy rozmaz i załącznik należą do tej samej kobiety. Wpisac ten sam numer na rozmazie i na załączniku (lub kod kreskowy).
- Zabarwic rozmaz metodą Papanicolaou.
- Nakryc rozmaz szkiełkiem nakrywkowym w DPX (optymalne rozmiary szkiełka nakrywkowego 22x50mm).
- Medium użyte do nakrycia szkiełka powinno wyschnąc zanim wraz z załącznikiem powędruje do pierwotnego skrinera.
Barwienie metodą Papanicolaou.
Papanicolaou opracował stosowaną do dzisiaj z niewielkimi modyfikacjami trichromową metodę barwienia rozmazów Papanicolaou G.: A new procedure for staining vaginal smears. Science 95,438,1942). Optymalne wyniki uzyskuje się jeżeli rozmazy nie wysychają ani na chwilę przed utrwaleniem i w czasie barwienia.
Barwienie Papanicolaou
Procedure Time Comment Remove polyethylene glycol carbowax fixative In 50% alcohol 2 min's Failure to remove carbowax will result in artifact which obscure the cells & is difficult to remove Rinse in water
1 min's Ensure re hydration is complete Stain in Harris Haematoxylin 5 min's Staining time will depend on formula of haematoxylin Rinse in water 2 min's Unbound haematoxylin is removed Differentiate in 0.5% aqueous hydrochloric acid 10-20 sec's Rinse in tap water 2 min's Blue in Scott’s tap water substitute 1 min's The brown colour of acid haematin is changed to blue/ black by weak alkaline solution Rinse in water 2 min's Wash thoroughly to remove alkaline salts Dehydrate 70%alcohol 2 min's Dehydrate through graded alcohols Dehydrate 95%alcohol 2 min's Dehydrate 95%alcohol 2 min's Stain in Orange G6 (OG6) 2 min's Rinse in 95%alcohol 2 min's Rinse in 95% alcohol 2 min's Rinse in 95% alcohol 2 min's Stain in Gills EA30 solution 3 min's Rinse in 95% alcohol x3 1 min Clear in xylene x3 and mount in DPX
1 min Leave in xylene until ready to mount in DPX Resulting stain:
- Nuclei- blue black
- Cytoplasm- non keratinised blue and effete red
- blood cells- green
- Cytoplasm (keratinised)- pink
- Red cells- orange
Po zabarwieniu cytoplazma powinna pozostac przejrzysta a struktura chromatyny jąder powinna być wyraznie czytelna.
Comment on the Papanicolaou staining method:
The Papanicolaou stain is a polychrome staining method which comprises a nuclear stain (haematoxylin) and two counterstains (Orange G and EA dyes). Hydration of the fixed smear is required for the cells to take up the haematoxylin whereas dehydration prepares the smear for the counterstains. Modification of the stain is common as each laboratory prefers its own colour balance. Adjustments are made by altering the length of time in haematoxylin and EA dye. Other factors which may affect the colour balance are chemical content of the tap water, temperature, pH of specimen and number of slides per batch of stain. Providing that the nuclear detail is clearly defined and the transparency of the cytoplasm is maintained, interlaboratory variation of the colour balance is acceptable. However each laboratory should standardise its procedure so the results are reproducible.The Papanicolaou staining method may progressive or regressive.
In the progressive method the intensity of nuclear staining is controlled by immersion of the slide in a “blueing” agent after the nucleus has been stained to the required intensity with haematoxylin. The blueing agents most commonly used are Scott’s tap water substitute (pH 8.02), ammonium hydroxide and lithium carbonate. (Tap water can be used if the pH is suitable). Progressive staining tints the cytoplasm very lightly.
In regressive staining, the nucleus is deliberately overstained with a non-acidified
haematoxylin. The excess stain is removed with dilute hydrochloric acid solution .The decolourising acid is then removed by immersing the slide in running tap water .Timing is important in the regressive method as the outcome may be a hypochromatic nucleus rather than a hyperchromatic nucleus. The cytoplasm is also totally decolourised by the acid solution. Harris’s haematoxylin is usually combined with the regressive staining method .Gill’s or Mayer’s haematoxylin is usually used for the progressive staining method.Orange G is an acidic dye which stains basic proteins such a prekeratin a pink colour. Orange G also has a strong affinity for keratin which stains bright orange. Thus it is an important marker of abnormal keratinisation of the cervical and vaginal epithelium such as occurs in prolapse and wart virus infection. It is also a sensitive marker of well differentiated squamous carcinoma of the cervix.
EA is a polychromatic stain which is a combination of light green, SF yellow and eosin Y. It stains the cytoplasm of metabolically active cells (such as parabasal cells intermediate cells leucocytes and histiocytes as well as cancer cells) a light green colour.
However, the colour balance of a Papanicolaou stained slide depends not only on the staining method used but also the commercial source of the stains and the pH of the cell sample. In consequence the Papanicolaou stain cannot be considered to be an exact stoichiometric stain although the correlation between Pap stained and Feulgen stained material is reportedly very high.For further information about the Papanicolaou stain and general cytopreparatory techniques please consult Chapter 34 , Cytopreparatory Techniques by CM Keebler in Comprehensive Cytopathology (1996) editor M Bibbo pub Saunders
Skrining i wynik badania
- Protokół skriningu powinien być uzgodniony z kierownikiem laboratorium z wdrożeniem zasad kontroli jakości i ustaleniem odpowiedniego do liczby osób obciążenia pracą.
- Aby nabrac dużego doświadczenia niezbędnym jest aby cytotechnicy oglądali szerokie spektrum zmian.Laboratorium powinno diagnozowac conajmniej 15 000 rozmazów z szyjki macicy rocznie a od każdego skrinera można oczekiwac oceny 50-80 rozmazów dziennie z przerwami co godzinę. Skriner powinien miec swoje stanowisko pracy i mikroskop biokular.
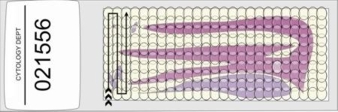
- Rozmazy należy oceniac używając obiektywu x10 i okularów x10 lub x12. Należy używac tego samego obiektywu do skriningu całego preparatu. Należy analizowac pole po polu aż cały obszar pod szkiełkiem nakrywkowym zostanie oceniony. Zwykle zaczyna się w jednym rogu szkiełka i przesuwa pole po polu aż cały obszar pod szkiełkiem nakrywkowym jest oceniony tak jak pokazano poniżej.
- It has been estimated that ,using low power objectives, a screener will have examined 250-300 fields of view during the process of screening a single slide . The average time taken to complete this process is 6-10 minutes (range 5 -20 minutes)
- To mark cells of interest , a 4x objective should be used. A protocol for marking cells should be in place in the laboratory.
- To inspect areas of special interest a 20x or 40x objective should be used.
- The cytology request form and cervical screening history should be provided with each smear and should be reviewed by the cytologist before examining the smear
Terminologia i zasady formułowania wyników badań cytologicznych szyjki macicy
- Wynik badania cytologicznego powinien być dokładny i konkretny tak aby był łatwo zrozumiały dla pobierającego wymaz, i pracowników medycznych, technicznych i administracyjnych zaangażowanych w program skriningowy.
- Terminologia musi przekazywac istotną klinicznie informację. Powszechnie się uważa, że można to osiągnąc najlepiej pisząc wynik w postaci dłuższego wyjaśniającego tekstu ponieważ wyniki formułowane skrótowo mogą prowadzić do błędnych interpretacji. Z tego powodu ,zdecydowanie odradza się stosowania klasyfikacji numerycznych z klasyfikacją Papanicolaou włącznie.
- Rodzaj preparatu, np. wymaz z szyjki, wymaz szczoteczkowy z kanału szyjki lub LBC.
- Komentarz na temat jakości rozmazu tzn. czy jest odpowiedni do oceny.
- Krótki opis stwierdzonych zmian cytologicznych w sposób powszechnie stosowany i zrozumiały.
- Jeżeli rozmaz jest nieprawidłowy należy podac jakim zmianom patologicznym stwierdzone cytologiczne zmiany powinny odpowiadac.
- Sugestie dotyczące dalszego postępowania (mogą ale nie muszą być wyrażone).
- Przed przygotowaniem wyniku badania cytologicznego cytolog powinien się zapoznac z odpowiednimi danymi klinicznymi.
- Rekomenduje się z naciskiem aby wyniki badań wszystkich nieprawidłowych rozmazów były formułowane przez patologa lub praktyka z odpowiednimi kwalifikacjami, który został specjalnie przeszkolony w patologii ginekologicznej.