| Introduction |
| Technical aspects |
| Normal lymph node histology and cytology |
| Reactive lymph node |
| Hodgkin Lymphoma |
| Non Hodgkin lymphoma |
| Metastases |
TEKNİK YÖNLER
- İİA’u ve yayma hazırlama
- Temel boyama
- İİS materyal yönetimi ve yardımcı teknikler
- Sitospin
- Hücre bloğu
- İmmünosiyokimya (İSK)
- Akım sitometri (AS)
- Floresan in situ hibridizasyon (FISH)
- Polimeraz zincir reaksiyonu (PCR)
İİS ve yayma hazırlama
- Palpe edilebilen lenf nodlarının İİA’u 23-25 gauge iğne ile aspirasyon ile ya da aspirasyonsuz uygulanmalıdır. Küçük lenf nodlarında (1cm ya da daha küçük) hedefe daha yaklaşabilmek için, aspirasyon ekipmanı olmadan, daha kısa iğne ile yaklaşım daha kolay olabilir.
- Lenf nodunu iki parmak arasında sabitleyin; aksiller lenf nodlarında hedefi iki parmak ucuyla ''aşağı çekerek'' göğüs duvarında sabitlemeye çalışın.
- Deri ve hedef arasındaki mesafeyi kısaltmaya çalışın ve orantısal olarak iğneyi gerekli mesafe boyunca sokun.
- Palpe edilemeyen veya derin lenf nodlarının İİA’nunun ultrason kontrolü altında uygulanması gereklidir. Bu durumda en kısa ve en direkt yolu seçin: yol ne kadar uzun ve ne kadar oblik ise iğnenin deviasyon riski o kadar fazla olur. İğne hareketleri sınırlıdır; lenf nodu yeterince büyükse en önemli kısmına ulaşmaya çalışın.
- Algılamalarınıza dikkat edin : deri ilk direnci , kapsül daha az direnci gösterir; lenf noduna girildiğinde ise bir boşluğa girmişsiniz gibi hissedersiniz, eğer öyleyse hedefe ulaştınız demektir.
- İğneyi hafifçe yukarı, aşağı ve yanlara, hedefin boyutuyla orantılı bir yarıçap çizerek haraket ettirin.
- İğneyi hareket ettirirken hastanın ağrı duyup duymadığını sorgulayın, eğer ağrı varsa hedeften sapmış olabilirsiniz.
- İğnelemeyi değerlendirin: yumuşak, sert, fibröz, parçalanan vb. Bu veriler yaymaları değerlendirirken size yardımcı olabilir.
- İğnenin 'hub' ını aspirasyon sırasında kontrol edin; materyal gelmeye başlayınca İİA’nunu durdurun ve yaymaları hazırlayın. İğne 'hub'ında kan görürseniz geçişi hemen durdurun; kan yaymanızı bozabilir ve mikrohemoraji ikinci bir geçişi riske atabilir.
- Aspirasyonlar, iğnelemede 'fibröz' olgular dışında, 20-30 saniyeyi aşmamalıdır, daha uzun aspirasyonlar yararsız olabilir veya mikrohemorajiye neden olabilir.
- Aspire materyali hafifçe püskürtün; eğer küçük damlalara bölerseniz tek geçişe ait ek yaymalar hazırlayabilir ya da materyali hücre bloğu veya yardımcı teknikler için kullanabilirsiniz.
- Yayma tekniğini materyalin kalitesine göre seçin: sıvı materyal için hematolojik teknik (periferik kan vb.) ve yoğun materyal için direkt yayma.
- Havada hemen kuruyan tek tabakalı yaymalar elde etmek için yayma yeterince hafif ve lenfositlerin morfolojilerini korumak için de yeterince nazik olmalıdır.
- Hemen Diff Quik ile boyadığınız bir yaymayı yeterlilik açısından ve materyali nasıl yöneteceğinize ve ek geçiş gerekliliğine karar vermek için değerlendirin.
Back to topTemel boyama
Diff Quik (May-Grunwald Giemsa) ve Papanicolaou birbirinin tamamlayıcısı olan ve en çok yarar sağlayan boya tipleridir. Diff Quik, yaymaların hemen değerlendirilebilmesini sağlar, zemini korur, fibröz bağ dokusu metakromazisini ve eozinofillerin oranj granüllerini vurgular. Papanicolaou, nükleus ve sitoplazma hakkında detaylı bilgi sağlar ve gerektiğinde yayma soldurularak immünositokimyasal boyalar için kullanılabilir.
İİS materyal yönetimi ve yardımcı teknikler
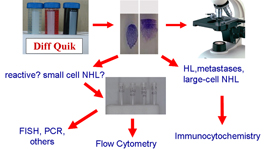
Diagnostik mateyalin yönetimi diagnostik sitoloji için, özellikle de lenf nodu sitopatolojisi için, çok önemli bir noktadır; mükemmel yaymalar ve bunların hemen değerlendirilmeleri doğru ve kesin tanı için ilk adımlardır. Kesin tanı için yardımcı teknikler gereklidir ve non-Hodgkin lenfoma (NHL) olguları için vazgeçilmezdir. Her şeye rağmen bu tekniklerin hepsi temel sitoloji laboratuvarlarında elde hazır değildir ve her birinin kendine has uygulamaları vardır. Aslında, NHL tanısı ve sınıflandırması için son derece yararlı bilgi sağlayan İİAS, Hodgkin lenfoma (HL) ve metastazların tanısında uygun değildir. Tersine, İSK morfolojik detaylar ve immünofenotipik özelliklerin birleşimiyle HL ve metastazların tanısında yüksek oranda katkı sağlarken, hafif zincir değerlendirmesinde ya da T-zengin B-hücreli NHL tanımlanmasında daha az etkili olabilir. FISH, spesifik NHL antitelerinin tanımlanmasında çok etkilidir fakat genellikle sadece öngörülen tanısal oryantasyonda kullanılır. Bu sorunlar, İİAS materyalinin genel olarak azlığı ve teknik kaynakların verimli kullanımının gerekliliği aşağıdaki algoritmayı önermiştir.
Yardımcı tekniklerin çoğu, lenf nodu İİS de tanı ve sınıflandırma için vazgeçilmezdir. Her biri spesifik bilgi sağlayabilir ve klinik veriler ile sitolojik özellikler birlikte göz önünde tutularak kullanılmalıdır.
Back to topSitospin
'Hub' da kalan ve/veya ikinci geçişte elde edilen materyal pH 7.4’lük tampon bir solüsyonda süspanse edilebilir. immünositokimya için kullanılabilecek altı ya da yedi sitospin hazırlamak için, tek bir geçişte kolaylıkla elde edilebilecek, bir veya iki milyon hücre gereklidir. Havada kurumuş sitospinler oda sıcaklığında 1 haftaya kadar saklanabilir; daha uzun süreler ( 1-2 yıl) için -20°de saklanmaları gerekir. Hem immünoalkali fosfataz hem de immünoperoksidaz sitospin üzerinde kullanılabilir.
Hücre Bloğu
Hücre blokları, santrifüj edilmiş hücre süspansiyon çökeltilerinin parafine gömülmesiyle hazırlanabilir; formalin tesbitli hücre süspansiyonları için Cytoblock kasetleri kullanılabilir. Hücre bloklarının ana avantajları çok sayıda kesit elde edilebilmesi, uzun süre saklanabilmeleri ve formalin tespitli histolojik kesitlerle aynı antijenik özellikte olmalarıdır.
İmmünositokimya (İSK)
Etanol tespitli yaymalar veya hücre bloklarından elde edilen ksilenle deparafinize ve alkolle rehidrate edilmiş parafin kesitler bu amaç için kullanılabilir. Lamlar 0.01 M tri-sodium sitrat solüsyonuyla dolu şalelere yerleştirilir ve mikrodalgada 5’er dakika 3 kez ısıtılır. Isıtmanın ardından lamlar; ılık, akan suda 5 dakika ve sonrasında ph 7.4 Tris-Buffer Salin (TBS) ile yıkanır. Primer Ab ile inkübasyonun ardından, lamlar biotinilize anti-mouse veya anti-rabbit immünoglobulinlerle kaplanır, peroksidaz işaretli streptavidini (LSAB) takiben 10 dakika Horse Peroxidase Enzime (HRP) inkübasyonundan sonra kromojen olarak diaminobenzidine (DAB) kullanılarak sinyal geliştirilir.
Akım sitometrisi (AS)
İğne haznesinde kalan ya da ek iğnelemelerle elde edilen materyal RMPI-1640 veya pH 7.4’de tampon solüsyonda süspanse edilebilir. Tek geçişle toplanabilecek bir ya da iki milyon hücre, temel floresan panel antikorları için altı tüpe dağıtılır. Bunlar çifte laser instrumanı kullanılarak farklı florokromlarla konjuge edilmiş üç veya dört antikor grubuyla kullanılır. Floresenize antikor konjugasyonu zamanında uygulanmalıdır zira süspansiyondaki vital hücreler şişebilir. Konjugasyon sonrasında hücre şişmesi bir damla tamponlanmış formalin eklenerek tespitle engellenebilir, böylece analiz ertelenebilir veya tekrarlanabilir. İİAS’nin avantajları: direkt antijen-antikor reaksiyonu, antijen ekspresyonunun tam sayımı , aynı hücrelerde iki farklı antikorun ko-ekspresyonudur. Dezavantajları ise morfolojinin yokluğu, büyük hücrelerin kaybı, sayısal olarak az hücre popülasyonlarının tanımlanma güçlüğü.
Floresan in situ hibridizasyon (FISH)
Spesifik DNA segmentlerini vizüalize etmek için floresenize DNA probları kullanılır. Kromozom anomalileri, yani translokasyonlar ve delesyonlar gözlenebilir ve ölçülebilir. FISH yaymalar veya sitospinler üzerinde uygulanabilir. Sitospin kullanımının avantajları: yüksek hücre konsantrasyonu, prob tasarrufu ve kısa analiz süresidir.
Polimeraz zincir reaksiyonu
Aspire hücreler, hem RNA hem de DNA prezervasyonu ve ekstraksiyonu için RNAlater® içinde süspanse edilebilir. DNA ekstraksiyonuna kadar hücreler oda sıcaklığında saklanabilir. DNA segmentleri oligonükleotid probları ve polimeraz enzimleriyle tekrarlayan denatürasyon, 'annealing' ve ekstansiyon döngüleriyle amplifiye edilir. Amplifikasyon ürünleri jel elektroforez veya kapiller elektroforez ile analiz edilebilir. Ig zincirlerinin JH lokusü veya Tc reseptörü amplifiye edilebilir ve monoklonalite veya poliklonalite için değerlendirilebilir.