| La prueba de Pap |
| Recolección de muestras |
| Guías de organización de laboratorio, procesamiento y screening |
| Terminología y elaboración de informes |
Guías para la organización de laboratorio, procesamiento y screening
Etapas en el proceso laboral en un laboratorio de citología:
- Recepción de muestras y formatos de solicitud en el laboratorio
- Asignación del número de referencia de laboratorio
- Ingreso de los datos de identificación del paciente y número de referencia al ordenador del laboratorio
- Tinción de los frotis, montaje y etiquetado
- Revisión de las láminas por el evaluador primario
- Todas las láminas revisadas por el segundo evaluador y las láminas anormales referidas al patólogo
- Preparación del informe final y envío a quien ha tomado el frotis
- La paciente es informada del resultado de la prueba
- Asegurar que se toman las medidas apropiadas en caso que los resultados sean anormales
La recepción de muestras
- Al recibir la muestra y la solicitud de análisis en el laboratorio, éstas se deben revisar para asegurarse que coinciden. Ambos, la muestra y la solicitud de análisis se deben asignar con el mismo número de referencia de laboratorio o código de barras.
- Se debe preparar la lámina para la tinción con el método de Papanicolaou
- Se debe montar la lámina en DPX luego de la tinción y cubrir con un cubreobjetos (tamaño óptimo 22 x 50mm)
- El medio de montaje se debe dejar secar antes que la lámina sea comparada nuevamente con la correspondiente solicitud y enviada para revisión
El método de tinción de Papanicolaou
Después de muchos años de experimentación, el Dr Papanicolaou desarrolló la tinción tricrómica que ha sobrevivido hasta hoy con pocas modificaciones y es la tinción aceptada para preparaciones de citología (Papanicolaou 1942: Un nuevo procedimiento para la tinción de frotis vaginales Science 95,438). Para una tinción óptima el frotis no debe dejarse secar en ningún momento antes del fijado o durante el procesado de la tinción de Papanicolaou.
Papanicolaou stain
Procedure Time Comment Remove polyethylene glycol carbowax fixative In 50% alcohol 2 min's Failure to remove carbowax will result in artifact which obscure the cells & is difficult to remove Rinse in water
1 min's Ensure re hydration is complete Stain in Harris Haematoxylin 5 min's Staining time will depend on formula of haematoxylin Rinse in water 2 min's Unbound haematoxylin is removed Differentiate in 0.5% aqueous hydrochloric acid 10-20 sec's Rinse in tap water 2 min's Blue in Scott’s tap water substitute 1 min's The brown colour of acid haematin is changed to blue/ black by weak alkaline solution Rinse in water 2 min's Wash thoroughly to remove alkaline salts Dehydrate 70%alcohol 2 min's Dehydrate through graded alcohols Dehydrate 95%alcohol 2 min's Dehydrate 95%alcohol 2 min's Stain in Orange G6 (OG6) 2 min's Rinse in 95%alcohol 2 min's Rinse in 95% alcohol 2 min's Rinse in 95% alcohol 2 min's Stain in Gills EA30 solution 3 min's Rinse in 95% alcohol x3 1 min Clear in xylene x3 and mount in DPX
1 min Leave in xylene until ready to mount in DPX Tinción resultante:
- Nucleo -azul negro
- Citoplasma (no queratinizado) - azul y rojo pálido
- Células sanguíneas-verde
- Citoplasma (queratinizado) -rosa
- Eritrocitos-naranja
El resultado final debe mantener la calidad transparente del citoplasma y la estructura de cromatina del núcleo debe ser claramente definida.
Comentario sobre el método de tinción de Papanicolaou:
La tinción de Papanicolaou es un método de tinción policromado que comprende una tinción nuclear (hematoxilina) y dos contratinciones (Naranja G y tintes EA). Se requiere la hidratación del frotis una vez fijado para que las células tomen la hematoxilina mientras que la deshidratación prepara al frotis para la contratinción. Es común que la tinción sea modificada pues cada laboratorio prefiere su propio balance de color. Los ajustes son realizados alterando el tiempo de duración de la hematoxilina y el tinte EA. Otros factores que pueden afectar el balance de color son el contenido químico del agua, la temperatura, el pH de la muestra y el número de láminas por lote de tinción. Con tal que sea claramente definido el detalle del núcleo y se mantenga la transparencia del citoplasma, la variación del balance de color entre laboratorios es aceptable. Sin embargo cada laboratorio debe estandarizar su procedimiento de tal forma que los resultados sean reproducibles.El método de tinción de Papanicolaou puede ser progresivo o regresivo.
En el método progresivo la intensidad de la tinción del núcleo es controlada mediante la inmersión de la lámina en un agente "azulador" después que el núcleo ha sido teñido a la intensidad requerida con hematoxilina. Los agentes azuladores mas comúnmente usados son el sustituto de agua potable de Scott (pH 8.02), hidróxido de amonio y carbonato de litio. (Se puede usar agua potable si el pH es adecuado).La tinción progresiva tiñe el citoplasma muy ligeramente.
En la tinción regresiva, el núcleo es deliberadamente sobreteñido con hematoxilina no-acidificada. El exceso de tinte se retira con una solución diluida de ácido hidroclórico. Luego se retira el ácido decolorante mediante la inmersión de la lámina en agua corriente. Contabilizar el tiempo es importante en el método regresivo pues el resultado puede ser un núcleo hipocromático en vez de un núcleo hipercromático. El citoplasma también es casi totalmente decolorizado por la solución ácida. La hematoxilina de Harris es combinada usualmente con el método de tinción regresivo. La hematoxilina de Gill or de Mayer es usualmente utilizada en el método de tinción progresiva.
El naranja G es un tinte acídico que tiñe las proteínas básicas como la prequeratina de color rosa. El naranja G también tiene una afinidad muy fuerte por la queratina que tiñe naranja brillante. Así, este es un marcador importante de la anormalidad.
EA es un tinte policromático que combina verde claro, amarillo SF y eosina Y. Este tiñe el citoplasma de las células metabólicamente activas (tales como las células parabasales, células intermedias, leucocitos e histiocitos y las células cancerígenas) de color verde claro. Sin embargo, el balance de color de la tinción de Papanicolaou depende no solo de los métodos de tinción utilizados, también depende de la fuente comercial de las tinciones y el pH de la célula muestra. En consecuencia, la tinción de Papanicolaou no puede ser considerada como una tinción estoicometrica exacta a pesar que hay una correlación muy alta reportada entre el material teñido con Pap y el teñido con Feulgen.
For further information about the Papanicolaou stain and general cytopreparatory techniques please consult Chapter 34 , Cytopreparatory Techniques by CM Keebler in Comprehensive Cytopathology (1996) editor M Bibbo pub Saunders
Revisión e informe
- Se debe acordar un protocolo de revisión de láminas con el director de laboratorio y se deben establecer las medidas de control de calidad y las proporciones de trabajadores/carga laboral apropiados.
- Es esencial que los citotecnólogos vean una amplia gama de casos para desarrollar experiencia. Los laboratorios deben procesar al menos 15.000 frotis cervicales al año y se espera que cada evaluador revise 50 a 80 frotis al día con descansos cada hora. El o ella debe tener su propio puesto de trabajo con microscopio binocular.
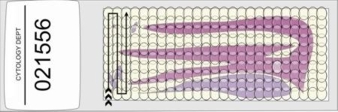
- Las láminas ya preparadas deben ser revisadas con un objetivo 10x y piezas de ojos de 10x o 12x. Se debe usar el mismo objetivo en la revisión de toda la lámina. El evaluador debe avanzar campo a campo transversalmente hasta que la totalidad del área bajo el cubreobjetos haya sido revisada. Es usual empezar la revisión en una esquina de la lámina y trabajar en una manera sistemática hasta que toda el área bajo el cubreobjetos sea examinada como se muestra a continuación.
- Se ha estimado que, usando objetivos de bajo poder, un evaluador habrá examinado 250 a 300 campos de visión durante el proceso de revisión de una sola lámina. El tiempo promedio para este proceso completo es de 6 a 10 minutos. (rango de 5 a 20 minutos)
- Se debe usar un objetivo de 4x para marcar las células de interés. Debe existir en el laboratorio un protocolo para marcar las células.
- Para inspeccionar las áreas de interés especial se debe utilizar un objetivo de 20x o 40x.
- Se debe suministrar con la solicitud de citología la historia de citologías cervicales y estas deben ser revisados por el citólogo antes de examinar el frotis.
Terminología y normas para el informe de frotis cervicales
- El informe de citología debe ser exacto y conciso de tal forma que su contenido sea fácil de entender por quien toma las muestras y el personal médico, técnico y administrativo relevante que está implicado en el screening de cáncer de cuello uterino.
- La terminología debe transmitir información clínica relevante a la persona que toma las muestras. Se acepta de forma general que esto es mejor logrado si el informe está escrito en forma de texto libre (narrativo) ya que textos taquigráficos pueden causar malentendidos. Por esta razón, no se promueve el uso de sistemas de clasificación numérica incluido el sistema propuesto por Papanicolaou (1954).
- El tipo de muestra se debe mencionar, p. ej raspado cervical, cepillado endocervical o muestra LBC.
- Se debe comentar si la muestra es adecuada esto es, si la muestra es satisfactoria para ser evaluada.
- El informe debe incluir una descripción breve de los hallazgos citológicos en términos que sean ampliamente usados y entendidos.
- En los casos en que los hallazgos citológicos sean anormales, los probables cambios patológicos en el cuello uterino deben ser mencionados.
- Una quinta parte del informe incluye sugerencias de manejo, pero esta es opcional.
- El citólogo debe tener en cuenta toda la información clínica relevante concerniente a la paciente antes de preparar el informe.
- Se recomienda que todos los frotis anormales sean reportados por un patólogo o un médico adecuadamente calificado con especial entrenamiento en patología ginecológica.